Abiturwissen Chemie Oberstufe/Elektrochemie/Grundlagen/Galvanisches Element
Die Ursprünge des galvanischen Element liegen bei dem Namensgeber Luigi Galvani. Dieser entdeckte Reize im Froschschenkel, wenn mit Utensilien aus verschiedenen Metallen gearbeitet wurde. Ursache hierfür war ein entstandenes Redox-System, welches eine elektrische Spannung aufbaute und Nerven-Impulse im Muskel verursachte.
In der grundlegenden Betrachtung dient das galvanische Element bzw. die galvanische Zelle zur Umwandlung von chemischer Energie in elektrische Energie.
Zelldiagrammschreibweise
Die Zelldiagrammschreibweise wird genutzt, um die beteiligten Elemente der galvanischen Zelle darzustellen. In dieser Schreibweise steht das Element mit der höheren Lösungstension auf der linken Seite. Das Element mit der niedrigeren Lösungstension steht auf der rechten Seite.
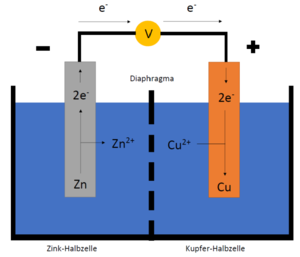
Beispiel: Zink und Kupfer
Zink hat eine höhere Lösungstension als Zink, somit hat es auch ein niedrigeres Elektrodenpotential. Deshalb steht es auf der linken Seite. Die Reaktion der Oxidation von Zink wird durch das Edukt, , und dem Produkt, , gezeigt. Dies ist durch einen Strich getrennt.
Zwischen den beiden Zellen liegt das Diaphragma, welches durch zwei Striche in dieser Schreibweise dargestellt wird. Das Edukt, , steht links neben dem Produkt, .