Aminosäuren
Aminosäuren sind Kohlenwasserstoffe. Sie besitzen als funktionelle Gruppen eine Carboxy-Gruppe () und eine Amino-Gruppe (). Über eine Peptidbindung können Aminosäuren zu Polypeptiden verknüpft werden. Solche Polypeptidketten bilden die Grundlage für Proteine.
Chiralität
Aminosäuren sind chiral. Damit weisen sie eine besondere Form der Isomerie auf. Man unterscheidet zwischen einer D-Aminosäure (von lat. dexter = rechts) und L-Aminosäuren (von lat. laevus = links). Diese Isomere verhalten sich wie Bild und Spiegelbild zueinander. Daher nennt man diese Form der Isomerie auch Spiegelbildisomerie und die Isomere werden Enantiomere genannt.
Entscheidend hierbei ist die Stellung der Amino-Gruppe am ersten asymetrischen C-Atom. Ein solches C-Atom besitzt vier verschiedende Liganden (Bindungspartner). Meist ist dies das α-C-Atom. Ist die Amino-Gruppe rechts am α-C-Atom, dann ist die Aminosäure eine D-Aminosäure. Ist die Amino-Gruppe links am α-C-Atom gebunden, dann handelt es sich um eine L-Aminosäure. L-Aminosäuren sind natürlich vorkommende.
Zwitterionen
Aminosäure-Moleküle werden in der allgemeinen Strukturformel als ungeladene Form dargestellt, allerdings existieren sie praktisch so nicht.
In wässriger, neutraler Lösung und in kristalliner Form liegen Aminosäuren als Zwitterionen bzw. Ampholyte vor. Ampholyt bedeutet, dass Zwitterionen als Säure oder als Base fungieren können.
Zwitterionen sind Ionen, welche zeitgleich eine negative und eine positive Ladung aufweisen. Hierbei handelt es sich um die positiv geladene Ammonium-Gruppe (-NH3+) und die negativ geladene Carboxylat-Gruppe (-COO-). Nach außen hin sind diese Moleküle somit elektrisch neutral geladen.
Daraus resultieren die hohen zwischenmolekularen Kräfte und die schlechte Löslichkeit, da die Zwitterionen ähnlich wie bei Kationen und Anionen Ionengitter mit starken Bindungen zwischen den Teilchen ausbilden.
Diese sind für die hohen Schmelztemperaturen von 292 °C der Aminosäure Glycin verantwortlich.
Löslichkeit
Der Lösungsvorgang bei Zwitterionen ist schwer, da sie sowohl eine positive als auch eine negative Ladung besitzen. Sie liegen zudem im Kristallgitter vor und sind somit sehr stabil. Zum Lösen ist deshalb ein hoher Energieaufwand nötig. Durch die Zugabe einer Base oder Säure wird die Löslichkeit einer Aminosäure erhöht.
Gibt man zu einer Aminosäure eine weitere Säure (z.B. H+) findet eine Protonierung statt. Ein Wasserstoffproton lagert sich an die negativ geladenen Carboxygruppe an. Das Aminosäuremolekül ist nach außen hin positiv geladen. Löst man dieses nun in Wasser, bildet sich eine Hydrathülle aus. Die Wassermoleküle lagern sich mit dem partiell negativ geladenen Sauerstoffatom am Ammonium-Kation der Aminosäure an.
Bei der Hinzugabe einer Base (z.B. OH-) zu einem Aminosäuremolekül findet hingegen eine Deprotonierung statt. Dabei wird ein Wasserstoffatom des Ammoniumkations abgespalten und das Molekül ist nach außen hin negativ geladen. In wässriger Lösung lagern sich anschließend die Wassermoleküle mit dem partiell positiv geladenen Wasserstoffatomen an das Carboxylat-Anion an.
Elektrophorese
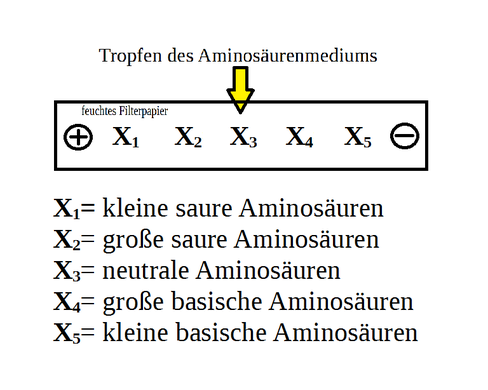
Verteilung der Aminosäuren
Mit einer polaren Flüssigkeit, die Strom leitet, wird ein Filterpapier befeuchtet und auf eine ebene Fläche gelegt.
Die zu analysierenden Aminosäuren werden in einem polaren Lösungsmittel aufgelöst.
Ein paar Tropfen der zu untersuchenden Lösung werden in die Mitte des Filterpapier gegeben und das Papier wird an Plus- und Minuspol einer Gleichspannungsquelle befestigt.
Die Aminosäuren, die durch die Restkette saurer als der pH-Wert des Mediums sind, wandern zum Pluspol, die die basischer sind zum Minuspol. (siehe IEP)
Je länger beziehungsweise größer die Restkette der Aminosäure ist, desto länger braucht die Aminosäure, um zu wandern. Aminosäuren, die als Zwitterionen vorliegen beziehungsweise neutral beim vorherrschenden pH-Wert sind, wandern gar nicht.