Abiturwissen Chemie Oberstufe/Proteine/Aminosäuren: Unterschied zwischen den Versionen
(Test) Markierung: 2017-Quelltext-Bearbeitung |
Keine Bearbeitungszusammenfassung |
||
| (9 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{{DISPLAYTITLE:Aminosäuren}} | {{DISPLAYTITLE:Aminosäuren}} | ||
[[Datei:Aminosäure allgemein.svg|mini|Struktur von Aminosäuren]] | [[Datei:Aminosäure allgemein.svg|mini|Struktur von Aminosäuren. Das C-Atom in der Mitte ist das α-C-Atom.]] | ||
Aminosäuren sind Kohlenwasserstoffe. Sie besitzen als funktionelle Gruppen eine Carboxy-Gruppe (<chem>R-COOH</chem>) und eine Amino-Gruppe (<chem>R-NH2</chem>). Über eine [[Abiturwissen_Chemie_Oberstufe/Proteine/Peptide/Peptidbindung|Peptidbindung]] können Aminosäuren zu Polypeptiden verknüpft werden. Solche Polypeptidketten bilden die Grundlage für [[Abiturwissen Chemie Oberstufe/Proteine|Proteine]]. | Aminosäuren sind Kohlenwasserstoffe. Sie besitzen als funktionelle Gruppen eine Carboxy-Gruppe (<chem>R-COOH</chem>) und eine Amino-Gruppe (<chem>R-NH2</chem>). Über eine [[Abiturwissen_Chemie_Oberstufe/Proteine/Peptide/Peptidbindung|Peptidbindung]] können Aminosäuren zu Polypeptiden verknüpft werden. Solche Polypeptidketten bilden die Grundlage für [[Abiturwissen Chemie Oberstufe/Proteine|Proteine]]. Das erste Kohlenstoffatom nach der Carboxy-Gruppe ist das α-C-Atom. Bei der Zählweise der [https://de.wikipedia.org/wiki/Fischer-Projektion Fischer-Projektion] ist dies das zweite C-Atom. Solche Aminosäuren bezeichnet man auch als α-Aminosäuren. | ||
=Chiralität= | =Chiralität= | ||
| Zeile 10: | Zeile 11: | ||
Entscheidend hierbei ist die Stellung der Amino-Gruppe am ersten asymetrischen C-Atom. Ein solches C-Atom besitzt vier verschiedende Liganden (Bindungspartner). Meist ist dies das α-C-Atom. Ist die Amino-Gruppe rechts am α-C-Atom, dann ist die Aminosäure eine D-Aminosäure. Ist die Amino-Gruppe links am α-C-Atom gebunden, dann handelt es sich um eine L-Aminosäure. L-Aminosäuren sind natürlich vorkommende. | Entscheidend hierbei ist die Stellung der Amino-Gruppe am ersten asymetrischen C-Atom. Ein solches C-Atom besitzt vier verschiedende Liganden (Bindungspartner). Meist ist dies das α-C-Atom. Ist die Amino-Gruppe rechts am α-C-Atom, dann ist die Aminosäure eine D-Aminosäure. Ist die Amino-Gruppe links am α-C-Atom gebunden, dann handelt es sich um eine L-Aminosäure. L-Aminosäuren sind natürlich vorkommende. | ||
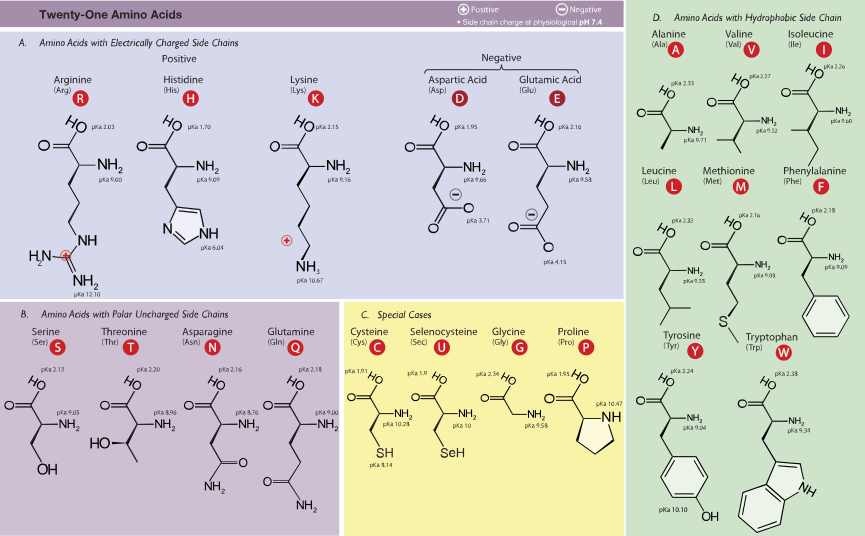
= | =Strukturen von Aminosäuren= | ||
[[Datei: | [[Datei:Amino_Acids-wide.svg|Amino Acids-wide]] | ||
<br /> | |||
{{DEFAULTSORT:Aminosäuren}} | {{DEFAULTSORT:Aminosäuren}} | ||
Aktuelle Version vom 21. März 2019, 08:13 Uhr
Aminosäuren sind Kohlenwasserstoffe. Sie besitzen als funktionelle Gruppen eine Carboxy-Gruppe () und eine Amino-Gruppe (). Über eine Peptidbindung können Aminosäuren zu Polypeptiden verknüpft werden. Solche Polypeptidketten bilden die Grundlage für Proteine. Das erste Kohlenstoffatom nach der Carboxy-Gruppe ist das α-C-Atom. Bei der Zählweise der Fischer-Projektion ist dies das zweite C-Atom. Solche Aminosäuren bezeichnet man auch als α-Aminosäuren.
Chiralität
Aminosäuren sind chiral. Damit weisen sie eine besondere Form der Isomerie auf. Man unterscheidet zwischen einer D-Aminosäure (von lat. dexter = rechts) und L-Aminosäuren (von lat. laevus = links). Diese Isomere verhalten sich wie Bild und Spiegelbild zueinander. Daher nennt man diese Form der Isomerie auch Spiegelbildisomerie und die Isomere werden Enantiomere genannt.
Entscheidend hierbei ist die Stellung der Amino-Gruppe am ersten asymetrischen C-Atom. Ein solches C-Atom besitzt vier verschiedende Liganden (Bindungspartner). Meist ist dies das α-C-Atom. Ist die Amino-Gruppe rechts am α-C-Atom, dann ist die Aminosäure eine D-Aminosäure. Ist die Amino-Gruppe links am α-C-Atom gebunden, dann handelt es sich um eine L-Aminosäure. L-Aminosäuren sind natürlich vorkommende.
Strukturen von Aminosäuren