Abiturwissen Chemie Oberstufe/Organische Chemie/Projektionsformeln: Unterschied zwischen den Versionen
Aus ZUM Projektwiki
KKeine Bearbeitungszusammenfassung |
K (Bisschen hinzugefügt und korrigiert) |
||
| Zeile 27: | Zeile 27: | ||
#Das Sauerstoffatom bei einem Fünfring befindet sich auf der vom Betrachter abgewandten Seite. Beim Sechsring befindet es sich in der rechten oberen Ecke. | #Das Sauerstoffatom bei einem Fünfring befindet sich auf der vom Betrachter abgewandten Seite. Beim Sechsring befindet es sich in der rechten oberen Ecke. | ||
#Bindungen, die in der Fischerprojektion links gezeichnet werden, werden oberhalb des Bindungspartners eingezeichnet. Bindungen, die in der Fischerprojektion rechts eingezeichnet werden, werden unterhalb des Bindungspartners eingezeichnet. | #Bindungen, die in der Fischerprojektion links gezeichnet werden, werden oberhalb des Bindungspartners eingezeichnet. Bindungen, die in der Fischerprojektion rechts eingezeichnet werden, werden unterhalb des Bindungspartners eingezeichnet. | ||
#Befindet sich die Hydroxygruppe des 1. C-Atoms des Rings oben, wird „α-“ vorne an den Namen des Zuckers angehängt (z. Bsp. α-D-Glucose). Befindet sich die Hydroxygruppe des 1. C-Atoms des Rings unten, wird „β“- vorne an den Namen des Zuckers angehängt ( | #Befindet sich die Hydroxygruppe des 1. C-Atoms des Rings oben, wird „α-“ vorne an den Namen des Zuckers angehängt (z. Bsp. α-D-Glucose). Befindet sich die Hydroxygruppe des 1. C-Atoms des Rings unten, wird „β“- vorne an den Namen des Zuckers angehängt (zum Beispiel β-D-Glucose). | ||
===Beispiele=== | ===Beispiele=== | ||
Aktuelle Version vom 8. Januar 2021, 09:13 Uhr
Fischer-Projektion
Anwendung
Die Fischerprojektion dient zur Darstellung dreidimensionaler, chiralen chemischen Bindungen. Durch feste Regeln können die Isomere eines Moleküls eindeutig zweidimensional dargestellt werden.
Regeln
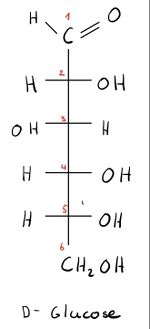
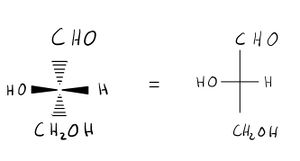
- Eine Kette von C- Atomen wird von oben nach unten gezeichnet. Grundsätzlich steht das am stärksten oxidierte C-Atom oben. Bei Kohlenwasserstoffen steht nach der Nomenklatur das C-Atom mit der Nummer 1 oben.
- Horizontale Linien zeigen aus der Betrachtungsebene heraus auf den Betrachter zu. Sie können auch durch ausgefüllte Keile, die zum Zentrum hin dünner werden, gezeichnet werden.
- Vertikale Linien zeigen vom Betrachter weg und verlaufen hinter der Projektionsebene. Sie können auch durch quergestrichelte Keile, die zum Zentrum hin dünner werden, gezeichnet werden.
- Befindet sich die Hydroxygruppe des vorletzten C-Atoms rechts, wird „D-“ vorne an den Namen des Zuckers angehängt (z. Bsp. D-Glucose). Befindet die Hydroxygruppe sich links, wird „L-“ an den Namen angehängt (z. Bsp. L-Glucose).
C-Atome können bei den Chiralitätszentren weggelassen werden. Dann steht das entstehende Kreuz für das C- Atom.
Beispiele
Haworth-Projektion
Anwendung
Die Haworth Projektion dient zur Darstellung von ringförmigen Molekülen. Der dreidimensionale Aufbau des Moleküls wird durch feste Regeln zweidimensional dargestellt.
Regeln
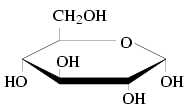
- Das Molekül wird als Fünf- oder Sechsring gezeichnet.
- Das Sauerstoffatom bei einem Fünfring befindet sich auf der vom Betrachter abgewandten Seite. Beim Sechsring befindet es sich in der rechten oberen Ecke.
- Bindungen, die in der Fischerprojektion links gezeichnet werden, werden oberhalb des Bindungspartners eingezeichnet. Bindungen, die in der Fischerprojektion rechts eingezeichnet werden, werden unterhalb des Bindungspartners eingezeichnet.
- Befindet sich die Hydroxygruppe des 1. C-Atoms des Rings oben, wird „α-“ vorne an den Namen des Zuckers angehängt (z. Bsp. α-D-Glucose). Befindet sich die Hydroxygruppe des 1. C-Atoms des Rings unten, wird „β“- vorne an den Namen des Zuckers angehängt (zum Beispiel β-D-Glucose).
Beispiele