Abiturwissen Chemie Oberstufe/Elektrochemie/Grundlagen/Nernst'sche Gleichung: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| (5 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
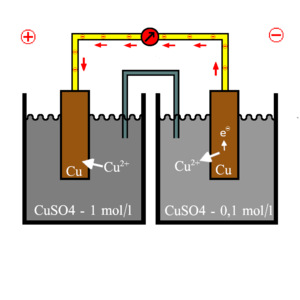
[[Datei:Konzentrationshalbzelle.png|mini|alternativtext=|Konzentrationshalbzelle]] | |||
Die NERNST'sche Gleichung wurde vom Chemiker Walther Nernst entwickelt. Sie dient zur Spannungsberechnung zweier Halbzellen und berücksichtigt dabei die Konzentrationsabhängigkeit. | |||
Die Konzentrationsabhängigkeit zeigt, dass in zwei Halbzellen, die sich nur in der Konzentration unterscheiden, eine Spannung gemessen werden kann. An der Halbzelle mit höherer Konzentration gehen somit weniger Atome in Lösung und in der Halbzelle mit niedrigerer Konzentration mehr. | |||
Normalerweise wird von der Standardtemperatur 25 ° Celsius ausgegangen. Sollte dieser Wert abweichen, so muss die Formel angepasst werden. Wenn dieser Wert nicht abweicht, so spielt die Temperatur keine Rolle in der Gleichung. | |||
NERNST'sche Gleichung: http://www.u-helmich.de/che/Q1/inhaltsfeld-3-ec/4-Konzentrationsabhaengigkeit/bilder/6007.jpg | |||
== pH-Abhängigkeit == | |||
Der pH-Wert hat einen starken Einfluss auf die Zellspannung. Wie stark dieser ist hängt auch damit zusammen, wie viele Wasserstoff-Protonen an der Reaktion beteiligt sind. Um nun die Spannung zu berechnen muss die NERNST'sche Gleichung angepasst werden: An die Stelle der Gleichung, an der die Konzentration der Donator-Halbzelle angegeben wird, muss nun als Faktor dahinter noch die Konzentration an Wasserstoff-Protonen potenziert mit der Anzahl der in der Redoxreaktion auftretenden Wasserstoff-Protonen. Mit Einberechnung dieses Faktors, kann sich das Ergebnis der Rechnung massiv verändern. | |||
Aktuelle Version vom 26. März 2019, 09:42 Uhr
Die NERNST'sche Gleichung wurde vom Chemiker Walther Nernst entwickelt. Sie dient zur Spannungsberechnung zweier Halbzellen und berücksichtigt dabei die Konzentrationsabhängigkeit.
Die Konzentrationsabhängigkeit zeigt, dass in zwei Halbzellen, die sich nur in der Konzentration unterscheiden, eine Spannung gemessen werden kann. An der Halbzelle mit höherer Konzentration gehen somit weniger Atome in Lösung und in der Halbzelle mit niedrigerer Konzentration mehr.
Normalerweise wird von der Standardtemperatur 25 ° Celsius ausgegangen. Sollte dieser Wert abweichen, so muss die Formel angepasst werden. Wenn dieser Wert nicht abweicht, so spielt die Temperatur keine Rolle in der Gleichung.
NERNST'sche Gleichung: http://www.u-helmich.de/che/Q1/inhaltsfeld-3-ec/4-Konzentrationsabhaengigkeit/bilder/6007.jpg
pH-Abhängigkeit
Der pH-Wert hat einen starken Einfluss auf die Zellspannung. Wie stark dieser ist hängt auch damit zusammen, wie viele Wasserstoff-Protonen an der Reaktion beteiligt sind. Um nun die Spannung zu berechnen muss die NERNST'sche Gleichung angepasst werden: An die Stelle der Gleichung, an der die Konzentration der Donator-Halbzelle angegeben wird, muss nun als Faktor dahinter noch die Konzentration an Wasserstoff-Protonen potenziert mit der Anzahl der in der Redoxreaktion auftretenden Wasserstoff-Protonen. Mit Einberechnung dieses Faktors, kann sich das Ergebnis der Rechnung massiv verändern.