Benutzer:GTQ2c1909: Unterschied zwischen den Versionen
(Verlinkung) |
Keine Bearbeitungszusammenfassung |
||
| (6 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 6: | Zeile 6: | ||
Projekt: '''[[Abiturwissen Chemie Oberstufe]]''' | Projekt: '''[[Abiturwissen Chemie Oberstufe]]''' | ||
[[Benutzer:GTQ2c1909/Primärelemente|Benutzer: | [[Benutzer:GTQ2c1909/Primärelemente|Benutzer:GTQ2c1909/Primärelemente]] | ||
='''Primärelemente'''= | |||
=====Lithium-Batterie (LiMnO<sub>2</sub>)===== | |||
'''Aufbau''': | |||
Die Kathode der Lithium-Mangandioxid-Batterie besteht aus wärmebehandeltem Mangandioxid (MnO2) und die Anode aus metallischem Lithium. | |||
[[Datei:LithiumBatterie.jpg|zentriert|467x467px|alternativtext=|mini]] | |||
'''Anodenreaktion:''' Li → Li<sup>+</sup> + e<sup>−</sup> | |||
'''Kathodenreaktion:''' MnO<sub>2</sub> + Li<sup>+</sup> + e<sup>−</sup> → LiMnO<sub>2</sub> | |||
'''Gesamtreaktion:''' Li + MnO<sub>2</sub> → LiMnO<sub>2</sub><br /> | |||
{| class="wikitable" | |||
!Vorteile | |||
!Nachteile | |||
|- | |||
|'''-''' niedrigstes Elektrodenpotenzial | |||
|<nowiki>- starke Reaktion mit Wasser,</nowiki> | |||
darf nicht damit in Berührung kommen | |||
|- | |||
| - kleinste Dichte | |||
| - aufwendige Herstellung/hohe Herstellungskosten | |||
|- | |||
| - hohe Spannung (2,8-3,6V) | |||
| - Alterserscheinungen: altert auch ohne Benutzung | |||
|- | |||
| - Leichtmetall | |||
| - Sicherheit: Probleme mit Überhitzung, vor allem durch | |||
Kontakt zweier Akkus (Transport) verursacht Brände | |||
|- | |||
| - geringe Selbstentladung lange Lagerfähigkeit | |||
| | |||
|} | |||
=====Alkali-Mangan-Batterie===== | |||
Die Alkali-Mangan-Batterie ist eine eine Fortentwicklung der Zink-Kohle-Batterie (Leclanché-Element). Der bedeutendste Unterschied zwischen den beiden Batterien ist, dass sich das Zink nicht in einem Zinkbecher außerhalb der Batterie befindet, sondern in einer Zinkpaste innerhalb der Batterie. | |||
[[Datei:AlkaliManganBatterie.jpg|zentriert|510x510px|alternativtext=|mini]] | |||
'''Anodenreaktion''': | |||
1. Zn<sub>(s)</sub> + 2OH<sup>-</sup><sub>(aq)</sub> → Zn(OH)<sub>2(s)</sub> + 2e<sup>-</sup> | |||
2. Zn(OH)<sub>(s)</sub> + 2OH<sup>-</sup><sub>(aq)</sub> → Zn[(OH)<sub>4</sub>]<sup>2-</sup><sub>(aq)</sub> | |||
'''Kathodenreaktion''': | |||
1. Mangan(IV)oxid wird zu Mangan(III)hydroxid reduziert: | |||
2MnO<sub>2</sub><sub>(s)</sub> + 2H<sub>2</sub>O<sub>(l)</sub> + 2e<sup>-</sup> → 2MnO(OH)<sub>(s)</sub> + 2OH<sup>-</sup><sub>(aq)</sub> | |||
'''Nebenreaktion:''' | |||
Zink wird oxidiert und Wasser zu gasförmigem Wasserstoff reduziert: | |||
Zn + 2H<sub>2</sub>O + 2OH<sup>-</sup> → [Zn(OH)<sub>4</sub>]²<sup>-</sup> + H<sub>2</sub> | |||
'''Vorteile: (Vergleich zur LeClanché-Batterie)''' | |||
- höhere Stromdichte | |||
- weniger Schwankungen | |||
- längere Betriebsdauer | |||
- hohe Auslaufsicherheit, jedoch kann sie aufgrund eines Kurzschlusses und des daraus resultierenden Überdrucks dennoch auslaufen | |||
- auch bei niedrigen Temperaturen funktionsfähig | |||
- geringere Selbstentladung | |||
<br /> | <br /> | ||
Aktuelle Version vom 21. März 2019, 07:54 Uhr
Schüler am Gymnasium Trittau, Schleswig-Holstein
Projekt: Abiturwissen Chemie Oberstufe
Benutzer:GTQ2c1909/Primärelemente
Primärelemente
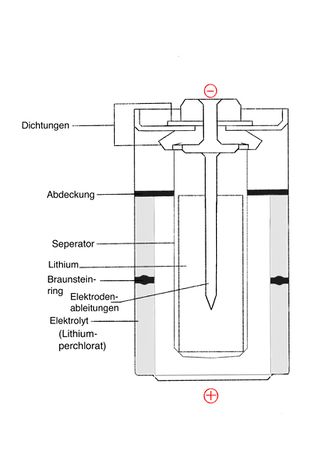
Lithium-Batterie (LiMnO2)
Aufbau:
Die Kathode der Lithium-Mangandioxid-Batterie besteht aus wärmebehandeltem Mangandioxid (MnO2) und die Anode aus metallischem Lithium.
Anodenreaktion: Li → Li+ + e−
Kathodenreaktion: MnO2 + Li+ + e− → LiMnO2
Gesamtreaktion: Li + MnO2 → LiMnO2
| Vorteile | Nachteile |
|---|---|
| - niedrigstes Elektrodenpotenzial | - starke Reaktion mit Wasser,
darf nicht damit in Berührung kommen |
| - kleinste Dichte | - aufwendige Herstellung/hohe Herstellungskosten |
| - hohe Spannung (2,8-3,6V) | - Alterserscheinungen: altert auch ohne Benutzung |
| - Leichtmetall | - Sicherheit: Probleme mit Überhitzung, vor allem durch
Kontakt zweier Akkus (Transport) verursacht Brände |
| - geringe Selbstentladung lange Lagerfähigkeit |
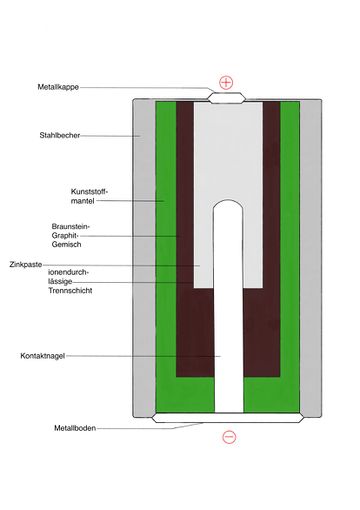
Alkali-Mangan-Batterie
Die Alkali-Mangan-Batterie ist eine eine Fortentwicklung der Zink-Kohle-Batterie (Leclanché-Element). Der bedeutendste Unterschied zwischen den beiden Batterien ist, dass sich das Zink nicht in einem Zinkbecher außerhalb der Batterie befindet, sondern in einer Zinkpaste innerhalb der Batterie.
Anodenreaktion:
1. Zn(s) + 2OH-(aq) → Zn(OH)2(s) + 2e-
2. Zn(OH)(s) + 2OH-(aq) → Zn[(OH)4]2-(aq)
Kathodenreaktion:
1. Mangan(IV)oxid wird zu Mangan(III)hydroxid reduziert:
2MnO2(s) + 2H2O(l) + 2e- → 2MnO(OH)(s) + 2OH-(aq)
Nebenreaktion:
Zink wird oxidiert und Wasser zu gasförmigem Wasserstoff reduziert:
Zn + 2H2O + 2OH- → [Zn(OH)4]²- + H2
Vorteile: (Vergleich zur LeClanché-Batterie)
- höhere Stromdichte
- weniger Schwankungen
- längere Betriebsdauer
- hohe Auslaufsicherheit, jedoch kann sie aufgrund eines Kurzschlusses und des daraus resultierenden Überdrucks dennoch auslaufen
- auch bei niedrigen Temperaturen funktionsfähig
- geringere Selbstentladung