Benutzer:GTQ2c1905/Lithium-Ionen-Akku
Allgemeines
■Verwendung bei mobilen Endgeräten wie Mobiltelefonen, Laptops und Kameras
■In den 1970er Jahren wurde das Funktionsprinzip an der TU München veröffentlicht
■1991 erster wiederaufladbarer Lithium-Ionen-Akku von Sony auf den Markt gebracht.
■Verschiedene Typen mit Cobaltdioxid, Mangandioxid, Eisenphosphat, Titanat und Zinn-Schwefel
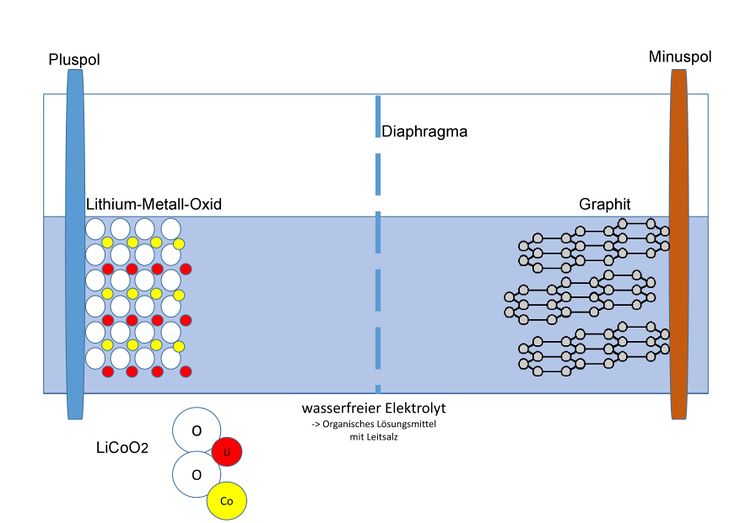
Aufbau
Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO2 beschrieben. Es liegt also in der Oxidationsstufe +III vor.
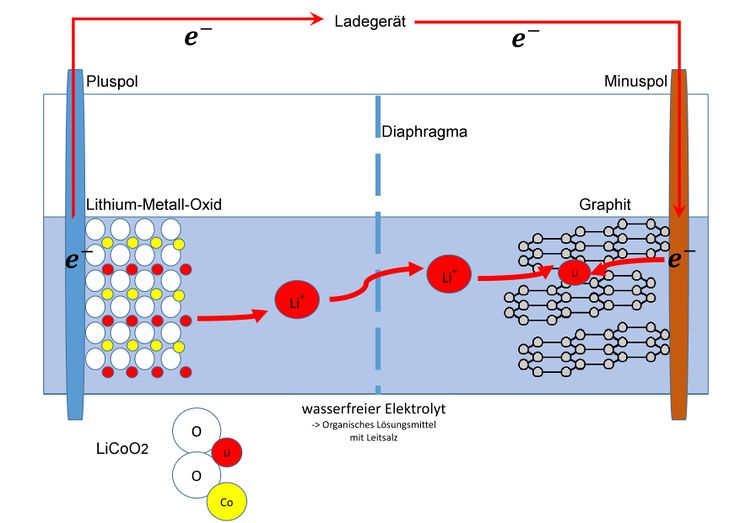
Ladeprozess
Beim Ladevorgang wandern Elektronen vom Ladegerät zum Minuspol. Um dies auszugleichen wandern dann auch Elektronen vom Pluspol zum Ladegerät. Vor dem Laden liegt das Lithium-Cobalt-Dioxid Molekül ungeladen mit folgenden Oxidationsstufen vor.
Li+ICo+IIIO2-II
Wenn jetzt ein Elektron abgegeben wird, wird das Cobalt eine Stufe höher oxidiert. Es liegt also wie folgt vor:
Li+ICo+IVO2-II
Wenn man jetzt die Oxidationszahlen zusammenrechnet wird deutlich dass es im Molekül eine psoitive Ladung zu viel gibt. Um dies auszugleichen löst sich ein Lithium-Ion und wandert durch das mikroporöse, für Lithium-Ionen durchlässige Diaphragma.
Co+IVO2-II+e-+Li+
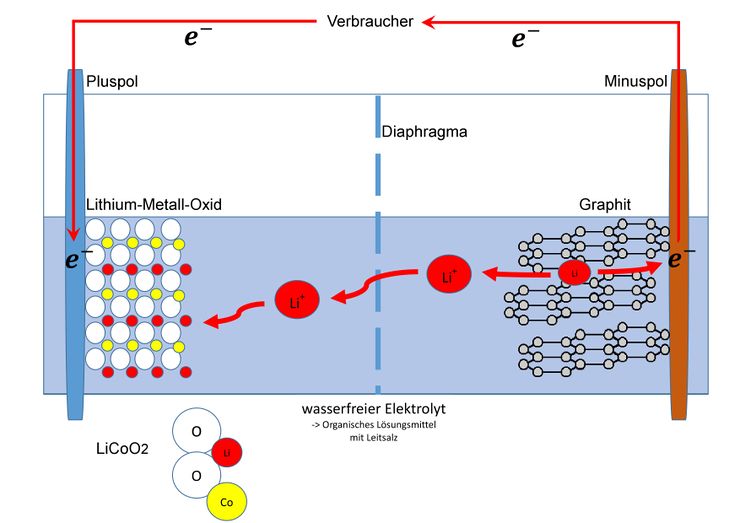
Auf der anderen Seite nimmt dieses Lithium-Ion dann ein Elektron auf und lagert sich in die Kohlenstoffschicht ein.