Benutzer:GTQ2c1905/Lithium-Ionen-Akku: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 16: | Zeile 16: | ||
[[Datei:Lithium Ionen Akku Laden.jpg|zentriert|alternativtext=|rahmenlos|740x740px]] | [[Datei:Lithium Ionen Akku Laden.jpg|zentriert|alternativtext=|rahmenlos|740x740px]] | ||
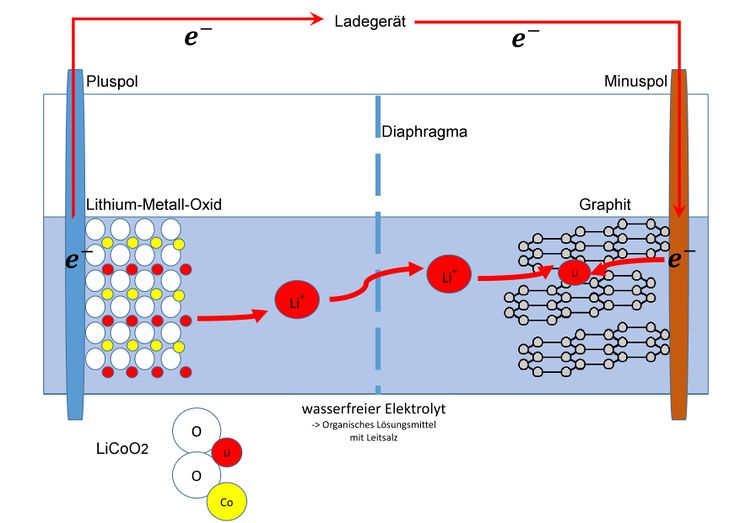
<big>Beim Ladevorgang wird die Kathode (also der Pluspol) oxidiert. Dadurch werden Elektronen abgegeben, welche über die Leitung zu der Anode wandern. Es entsteht ein chemisches Ungleichgewicht. Die Lithium-Ionen (Li+) trennen sich deshalb vom Metalloxid (blau) und wandern durch den Separator. Auf der anderen Seite lagern sie sich zwischen den Kohlenstoffschichten (hier am Beispiel Graphit) ein.<br /></big> | |||
Version vom 19. März 2019, 09:05 Uhr
Allgemeines
■Verwendung bei mobilen Endgeräten wie Mobiltelefonen, Laptops und Kameras
■In den 1970er Jahren wurde das Funktionsprinzip an der TU München veröffentlicht
■1991 erster wiederaufladbarer Lithium-Ionen-Akku von Sony auf den Markt gebracht.
■Verschiedene Typen mit Cobaltdioxid, Mangandioxid, Eisenphosphat, Titanat und Zinn-Schwefel
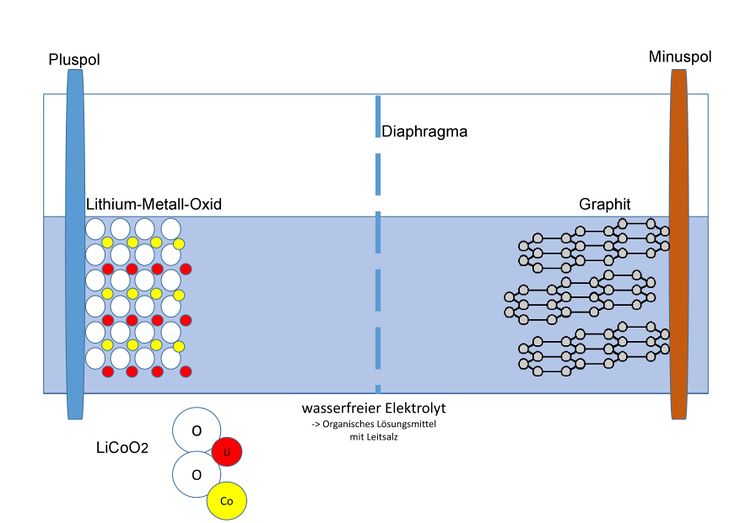
Aufbau
Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO2 beschrieben. Es liegt also in der Oxidationsstufe +III vor.
Ladeprozess
Beim Ladevorgang wird die Kathode (also der Pluspol) oxidiert. Dadurch werden Elektronen abgegeben, welche über die Leitung zu der Anode wandern. Es entsteht ein chemisches Ungleichgewicht. Die Lithium-Ionen (Li+) trennen sich deshalb vom Metalloxid (blau) und wandern durch den Separator. Auf der anderen Seite lagern sie sich zwischen den Kohlenstoffschichten (hier am Beispiel Graphit) ein.