Abiturwissen Chemie Oberstufe/Organische Chemie/Alkanole: Unterschied zwischen den Versionen
Markierung: 2017-Quelltext-Bearbeitung |
Markierung: 2017-Quelltext-Bearbeitung |
||
| (16 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 9: | Zeile 9: | ||
Alkanole leiten sich von den '''Alkanen''' ab und verfügen über eine oder mehrere '''Hydroxy-Gruppen (OH-Gruppe) als funktionelle Gruppe'''. Die OH-Gruppe ist dabei polar, der Alkylrest unpolar. | Alkanole leiten sich von den '''Alkanen''' ab und verfügen über eine oder mehrere '''Hydroxy-Gruppen (OH-Gruppe) als funktionelle Gruppe'''. Die OH-Gruppe ist dabei polar, der Alkylrest unpolar. | ||
<br />Der '''Name''' eines | <br />Der '''Name''' eines Alkanols wird gebildet, indem an den Namen des entsprechenden '''Alkans''' die Endung '''–ol''' angehängt wird. | ||
==<big>2. Unterteilung</big>== | ==<big>2. Unterteilung</big>== | ||
| Zeile 28: | Zeile 28: | ||
Für die Anzahl der OH-Gruppen wird das entsprechende griechische Zahlwort vor der Endung eingefügt. | Für die Anzahl der OH-Gruppen wird das entsprechende griechische Zahlwort vor der Endung eingefügt. | ||
Beim Vorhandensein von Alkylgruppen werden diese gemäß der IUPAC-Regeln vorangestellt. | Beim Vorhandensein von Alkylgruppen werden diese gemäß der IUPAC-Regeln vorangestellt. | ||
[[Datei:Strukturformel.png|mini]rand]] | |||
Unter Einhaltung der genannten Regeln ergibt sich für obige Strukturformel der Name 3-Methylbutan-2-ol. | |||
==<big>4. Eigenschaften</big>== | ==<big>4. Eigenschaften</big>== | ||
| Zeile 39: | Zeile 43: | ||
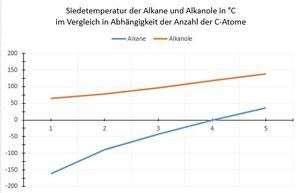
<u>Siedetemperatur:</u> | <u>Siedetemperatur:</u> | ||
Die Siedetemperatur der Alkanole '''steigt''' mit '''zunehmender Anzahl an C-Atomen''' und ist stets '''höher als''' die der entsprechenden '''Alkane'''. Ursache sind auch hier die Wasserstoffbrückenbindungen, die die OH-Gruppe ausbildet. | Die Siedetemperatur der Alkanole '''steigt''' mit '''zunehmender Anzahl an C-Atomen''' und | ||
ist stets '''höher als''' die der entsprechenden '''Alkane'''. Ursache sind auch hier die Wasserstoffbrückenbindungen, die die OH-Gruppe ausbildet. | |||
<br /> | |||
<big>[[Datei:Diagramm.jpg|mini|zentriert]]</big> | |||
== <big>5. Oxidation von Alkanolen</big> == | ==<big>5. Oxidation von Alkanolen</big>== | ||
'''Primäre''' Alkanole oxidieren leicht mit Sauerstoff. Dabei entsteht zuerst aus dem Alkanol ein '''Alkanal (Aldehyd)'''. Durch die weitere Oxidation entsteht eine '''Carbonsäure'''. | '''Primäre''' Alkanole oxidieren leicht mit Sauerstoff. Dabei entsteht zuerst aus dem Alkanol ein '''Alkanal (Aldehyd)'''. Durch die weitere Oxidation entsteht eine '''Carbonsäure'''. | ||
'''Sekundäre''' | '''Sekundäre''' Alkanole oxidieren nur bis zum '''Keton'''. Eine weitere Oxidation ist nicht möglich. | ||
<br />'''Tertiäre''' Alkanole können '''nicht''' oxidiert werden. | <br />'''Tertiäre''' Alkanole können '''nicht''' oxidiert werden. | ||
Aktuelle Version vom 30. November 2020, 17:33 Uhr
1. Allgemeines
Alkanole sind eine Stoffgruppe in der Organischen Chemie und stellen eine Untergruppe der Alkohole dar. Die Begriffe Alkohol und Alkanol sind also nicht bedeutungsgleich.
Alkanole leiten sich von den Alkanen ab und verfügen über eine oder mehrere Hydroxy-Gruppen (OH-Gruppe) als funktionelle Gruppe. Die OH-Gruppe ist dabei polar, der Alkylrest unpolar.
Der Name eines Alkanols wird gebildet, indem an den Namen des entsprechenden Alkans die Endung –ol angehängt wird.
2. Unterteilung
Je nachdem wie viele benachbarte Kohlenstoff-Atome sich noch an dem Kohlenstoff-Atom befinden, an welchem die Hydroxy-Gruppe gebunden ist, unterscheidet man zwischen primären, sekundären und tertiären Alkanolen.
Bei primären Alkanolen ist die Hydroxy-Gruppe endständig.
Bei sekundären Alkanolen ist das mit der Hydroxy-Gruppe verbundene Kohlenstoffatom mit zwei weiteren Kohlenstoffatomen verbunden.
Analog ist bei tertiären Alkanolen das mit der Hydroxy-Gruppe verbundene Kohlenstoffatom mit drei weiteren Kohlenstoffatomen verbunden.
Eine weitere Unterteilung erfolgt hinsichtlich der Anzahl der OH-Gruppen in ein- und mehrwertige Alkanole. Während einwertige Alkanole lediglich über eine OH-Gruppe verfügen, so besitzen mehrwertige Alkanole mindestens zwei Hydroxy-Gruppen.
3. Benennung der Alkanole
Man benennt zunächst das Alkan. Die Lage der Hydroxy-Gruppe wird durch eine Ziffer vor der Endung -ol angegeben. Dabei werden immer die Kohlenstoff-Atome der längsten Kohlenstoff-Kette gezählt und zwar so, dass die Hydroxy-Gruppe eine möglichst kleine Zahl erhält. Für die Anzahl der OH-Gruppen wird das entsprechende griechische Zahlwort vor der Endung eingefügt. Beim Vorhandensein von Alkylgruppen werden diese gemäß der IUPAC-Regeln vorangestellt.
Unter Einhaltung der genannten Regeln ergibt sich für obige Strukturformel der Name 3-Methylbutan-2-ol.
4. Eigenschaften
Löslichkeit:
Für die Wasserlöslichkeit von Alkanolen ist die OH-Gruppe von entscheidender Bedeutung. Zwischen der polaren OH-Gruppe des Alkanols und den Wassermolekülen bilden sich Wasserstoffbrücken.
Allerdings nimmt die Wasserlöslichkeit von Alkanolen mit steigender Anzahl der C-Atome ab, so lassen sich Methanol, Ethanol und Propanol noch problemlos in Wasser lösen, während sich Butanol schon schwieriger lösen lässt.
Siedetemperatur:
Die Siedetemperatur der Alkanole steigt mit zunehmender Anzahl an C-Atomen und ist stets höher als die der entsprechenden Alkane. Ursache sind auch hier die Wasserstoffbrückenbindungen, die die OH-Gruppe ausbildet.
5. Oxidation von Alkanolen
Primäre Alkanole oxidieren leicht mit Sauerstoff. Dabei entsteht zuerst aus dem Alkanol ein Alkanal (Aldehyd). Durch die weitere Oxidation entsteht eine Carbonsäure.
Sekundäre Alkanole oxidieren nur bis zum Keton. Eine weitere Oxidation ist nicht möglich.
Tertiäre Alkanole können nicht oxidiert werden.
6. Alkanole und Desinfektion
Einwertige Alkanole sind laut RKI deutlich besser hautverträglich als Handwaschpräparate. Einwertige Alkanole trocknen schnell an der Luft und sind daher in der Anwendung komfortabel. Eine Resistenzentwicklung von Keimen ist aufgrund des Wirkmechanismus nicht bekannt.
Zur Händedesinfektion sind Ethanol-basierte Mittel mit einem Gehalt ab 62 % Ethanol wirksam. Auch Händedesinfektionsmittel auf Propanol-Basis sind gut geeignet. Die Wirksamkeit steigt mit zunehmender Kettenlänge (bis 8 C-Atome), allerdings nimmt die Verträglichkeit ab. Daher sind einwertige Alkanole mit mehr als 4 C-Atomen nicht für Händedesinfektion geeignet.

![mini]rand](/images/9/9d/Strukturformel.png)