Benutzer:GTQ2c1909
Schüler am Gymnasium Trittau, Schleswig-Holstein
Projekt: Abiturwissen Chemie Oberstufe
Benutzer:GTQ2c1909/Primärelemente
Primärelemente
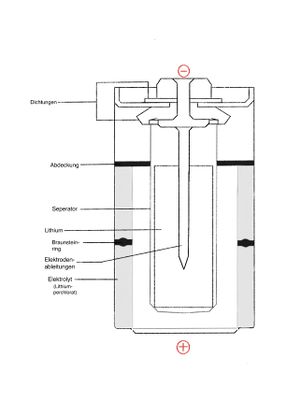
Lithium-Batterie (LiMnO2)
Aufbau:
Die Kathode der Lithium-Mangandioxid-Batterie besteht aus wärmebehandeltem Mangandioxid (MnO2) und die Anode aus metallischem Lithium.
Anodenreaktion: Li → Li+ + e−
Kathodenreaktion: MnO2 + Li+ + e− → LiMnO2
Gesamtreaktion: Li + MnO2 → LiMnO2
| Vorteile | Nachteile |
|---|---|
| - niedrigstes Elektrodenpotenzial | - starke Reaktion mit Wasser,
darf nicht damit in Berührung kommen |
| - kleinste Dichte | - aufwendige Herstellung/hohe Herstellungskosten |
| - hohe Spannung (2,8-3,6V) | - Alterserscheinungen: altert auch ohne Benutzung |
| - Leichtmetall | - Sicherheit: Probleme mit Überhitzung, vor allem durch
Kontakt zweier Akkus (Transport) verursacht Brände |
| - geringe Selbstentladung lange Lagerfähigkeit |
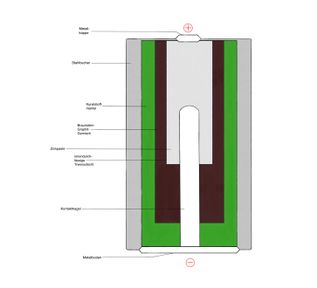
Alkali-Mangan-Batterie
Die Alkali-Mangan-Batterie ist eine eine Fortentwicklung der Zink-Kohle-Batterie (Leclanché-Element). Der bedeutendste Unterschied zwischen den beiden Batterien ist, dass sich das Zink nicht in einem Zinkbecher außerhalb der Batterie befindet, sondern in einer Zinkpaste innerhalb der Batterie.
Anodenreaktion:
1. Zn(s) + 2OH-(aq) → Zn(OH)2(s) + 2e-
2. Zn(OH)(s) + 2OH-(aq) → Zn[(OH)4]2-(aq)
Kathodenreaktion:
1. Mangan(IV)oxid wird zu Mangan(III)hydroxid reduziert:
2MnO2(s) + 2H2O(l) + 2e- → 2MnO(OH)(s) + 2OH-(aq)
Nebenreaktion:
Zink wird oxidiert und Wasser zu gasförmigem Wasserstoff reduziert:
Zn + 2H2O + 2OH- → [Zn(OH)4]²- + H2
Vorteile: (Vergleich zur LeClanché-Batterie)
- höhere Stromdichte
- weniger Schwankungen
- längere Betriebsdauer
- hohe Auslaufsicherheit, jedoch kann sie aufgrund eines Kurzschlusses und des daraus resultierenden Überdrucks dennoch auslaufen
- auch bei niedrigen Temperaturen funktionsfähig
- geringere Selbstentladung
Zink-Kohle-Batterie
https://www.u-helmich.de/che/Q1/inhaltsfeld-3-ec/61-Batterien/seiteEC-61A1.html
Anodenreaktion:
Zn(s) → Zn²+ + 2e-
Kathodenreaktion:
2MnO2 + 2H2O + 2e- → 2MnO(OH) + 2OH-
Sekundärreaktionen: (NH4 aus dem Elektrolyten)
1. 2NH4+ + 2OH- → 2NH3 + 2H2O
2. Zn²+ + 2NH3 → [Zn(NH3)2]²+
3. [Zn(NH3)2]²+ + 2Cl- → [Zn(NH3)2]Cl2
| Vorteile | Nachteile |
|---|---|
| - giftige Stoffe binden an einen unlöslichen Komplex | - elektrischer Widerstand nimmt zu |
| - gleichzeitig sinkt die Leistung | |
| - Zinkbecher kann porös werden → Gefahr des Auslaufens des Elektrolyten steigt | |
| - hohe Selbstentladung |