Abiturwissen Chemie Oberstufe/Elektrochemie/Sekundärelemente/Lithium-Ionen-Akku: Unterschied zwischen den Versionen
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung Markierung: Quelltext-Bearbeitung 2017 |
||
| Zeile 9: | Zeile 9: | ||
==='''<big>Aufbau</big>'''=== | ==='''<big>Aufbau</big>'''=== | ||
[[Datei:Lithium | [[Datei:Lithium-Ionen Akku mit Graphit.jpg|zentriert|rahmenlos|740x740px]] | ||
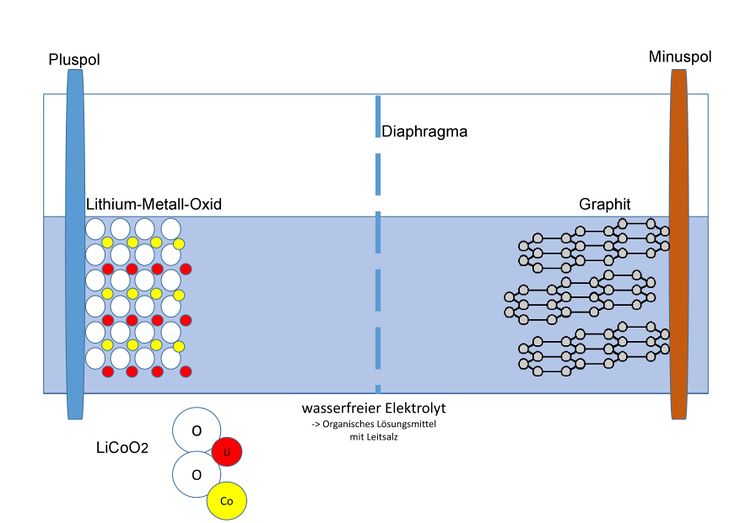
Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO<sub>2</sub> beschrieben. Es liegt also in der Oxidationsstufe III vor. | Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO<sub>2</sub> beschrieben. Es liegt also in der Oxidationsstufe III vor. | ||
Version vom 14. März 2019, 12:22 Uhr
Allgemeines
■Verwendung bei mobilen Endgeräten wie Mobiltelefonen, Laptops und Kameras
■In den 1970er Jahren wurde das Funktionsprinzip an der TU München veröffentlicht
■1991 erster wiederaufladbarer Lithium-Ionen-Akku von Sony auf den Markt gebracht.
■Verschiedene Typen mit Cobaltdioxid, Mangandioxid, Eisenphosphat, Titanat und Zinn-Schwefel
Aufbau
Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO2 beschrieben. Es liegt also in der Oxidationsstufe III vor.