Abiturwissen Chemie Oberstufe/Elektrochemie/Sekundärelemente/Lithium-Ionen-Akku: Unterschied zwischen den Versionen
K (GTQ2c1907 verschob die Seite Lithium-Ionen-Akku nach Abiturwissen Chemie Oberstufe/Elektrochemie/Sekundärelemente/Lithium-Ionen-Akku) |
Keine Bearbeitungszusammenfassung |
||
| (3 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 7: | Zeile 7: | ||
<big>■Verschiedene Typen mit Cobaltdioxid, Mangandioxid, Eisenphosphat, Titanat und Zinn-Schwefel</big> | <big>■Verschiedene Typen mit Cobaltdioxid, Mangandioxid, Eisenphosphat, Titanat und Zinn-Schwefel</big> | ||
==='''<big>Aufbau</big>'''=== | ==='''<big>Aufbau</big>'''=== | ||
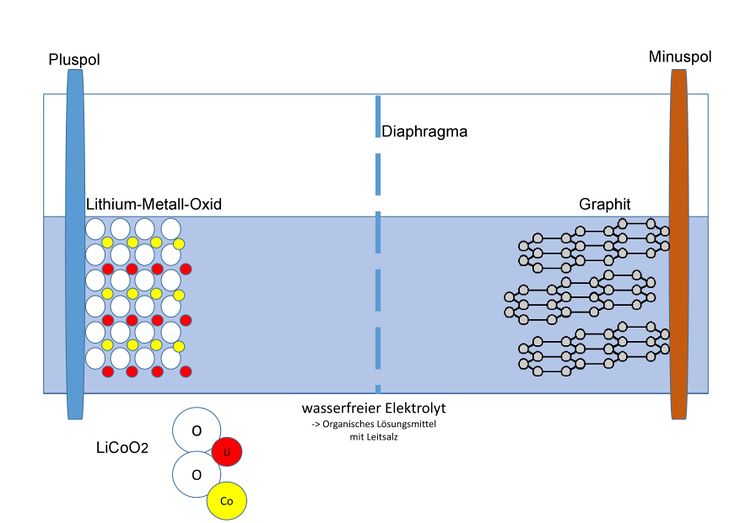
[[Datei:Lithium-Ionen Akku mit Graphit.jpg|zentriert|rahmenlos|740x740px]] | <br />[[Datei:Lithium-Ionen Akku mit Graphit.jpg|zentriert|rahmenlos|740x740px]]<big>Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO<sub>2</sub> beschrieben. Es liegt also in der Oxidationsstufe +III vor.</big> | ||
Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO<sub>2</sub> beschrieben. Es liegt also in der Oxidationsstufe III vor. | |||
<br /> | |||
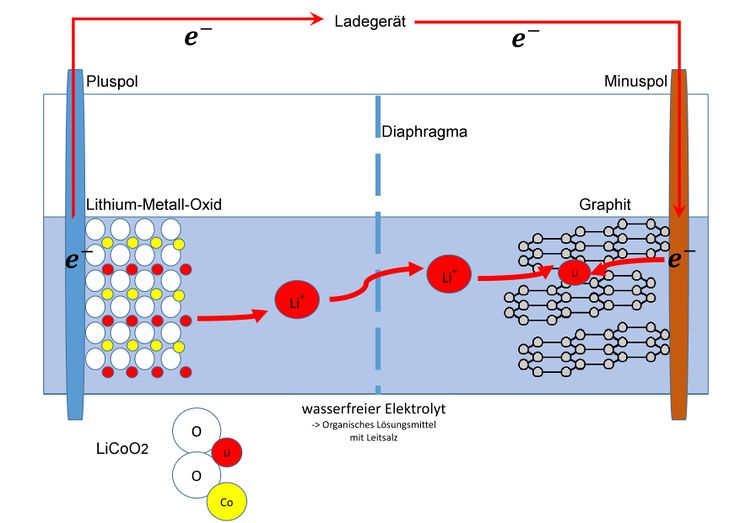
==='''<big>Ladeprozess</big>'''=== | |||
<br />[[Datei:Lithium Ionen Akku Laden.jpg|zentriert|alternativtext=|rahmenlos|740x740px]] | |||
<big>Beim Ladevorgang wandern Elektronen vom Ladegerät zum Minuspol. Um dies auszugleichen wandern dann auch Elektronen vom Pluspol zum Ladegerät. Vor dem Laden liegt das Lithium-Cobalt-Dioxid Molekül ungeladen mit folgenden Oxidationsstufen vor.</big><blockquote><big> | |||
<big>Li<sup>''+I''</sup>Co<sup>''+III''</sup>O<sub>2</sub><sup>''-II''</sup></big> | |||
</big></blockquote><big>Wenn jetzt ein Elektron abgegeben wird, wird das Cobalt eine Stufe höher oxidiert. Es liegt also wie folgt vor:</big><blockquote> | |||
<big>Li<sup>''+I''</sup>Co<sup>''+IV''</sup>O<sub>2</sub><sup>''-II''</sup></big> | |||
</blockquote><big>Wenn man jetzt die Oxidationszahlen zusammenrechnet wird deutlich dass es im Molekül eine psoitive Ladung zu viel gibt. Um dies auszugleichen löst sich ein Lithium-Ion und wandert durch das mikroporöse, für Lithium-Ionen durchlässige Diaphragma.</big> | |||
<blockquote><big> | |||
<big>Co''<sup>+IV</sup>''O<sub>2</sub><sup>''-II''</sup>+e<sup>-</sup>+Li<sup>+</sup></big> | |||
</big></blockquote> | |||
<big>Auf der anderen Seite nimmt dieses Lithium-Ion dann ein Elektron auf und lagert sich in die Kohlenstoffschicht ein.</big> | |||
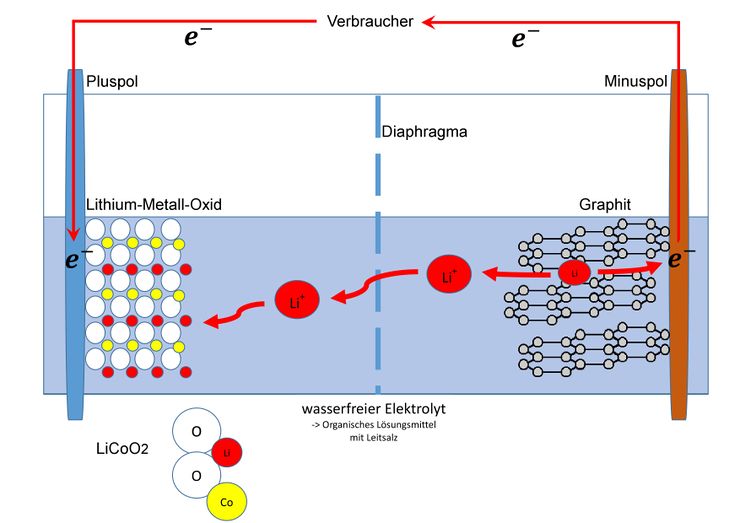
===<big> '''Entladeprozess'''</big>=== | |||
<br />[[Datei:Lithium_Ionen_Akku_Entladen.jpg|alternativtext=|zentriert|rahmenlos|740x740px]] | |||
<big>Wenn nun ein Verbraucher angeschlossen wird kehrt sich der Elektronenfluss um. So werden auf Seite der Anode die Elektronen wieder abgegeben und auf Seiten der Kathode wieder aufgenommen. Dadurch wird das Lithium in der Kohlenstoffschicht wieder oxidiert und der Cobalt-Dioxid-Komplex wieder reduziert. So wird der Lithium-Cobalt-Dioxid-Komplex wieder vollständig hergestellt.</big> <blockquote><big> | |||
'''<big>Li -> Li<sup>+</sup> + e<sup>-</sup></big>''' | |||
</big></blockquote><big><br /></big><blockquote><big> | |||
'''<big>Co<sup>''+IV''</sup>O<sub>2</sub><sup>''-II''</sup>+e<sup>-</sup> -> Co<sup>''+III''</sup>O2<sup>''-II''</sup> </big>''' | |||
</big></blockquote><big><br /></big><blockquote><big> | |||
'''<big>Co<sup>''+III''</sup>O2<sup>''-II''</sup>+Li<sup>+</sup> -> Li<sup>''+I''</sup>Co<sup>''+III''</sup>O<sub>2</sub><sup>''-II''</sup></big>''' | |||
</big></blockquote> | |||
<br /> | |||
==='''<big>Redoxgleichungen</big>'''=== | |||
<blockquote><br /> | |||
<big>'''Ox: '''LiCoO<sub>2</sub> ⇌ CoO<sub>2</sub> + Li<sup>+</sup> + e<sup>-</sup> ''' '''</big></blockquote><blockquote><big>'''Red: ''' Graphit + e<sup>-</sup> + Li<sup>+</sup> ⇌ LiGraphit</big></blockquote><blockquote><big><br /> | |||
'''Redox: '''CoO<sub>2</sub>+Graphit<sup>-</sup> + (Li<sup>+</sup>) ⇌ CoO<sub>2</sub><sup>-</sup> + Graphit + (Li<sup>+</sup>)</big></blockquote><br /> | |||
Aktuelle Version vom 21. März 2019, 08:09 Uhr
Allgemeines
■Verwendung bei mobilen Endgeräten wie Mobiltelefonen, Laptops und Kameras
■In den 1970er Jahren wurde das Funktionsprinzip an der TU München veröffentlicht
■1991 erster wiederaufladbarer Lithium-Ionen-Akku von Sony auf den Markt gebracht.
■Verschiedene Typen mit Cobaltdioxid, Mangandioxid, Eisenphosphat, Titanat und Zinn-Schwefel
Aufbau
Als Material für den Minuspol dient Graphit; die Kohlenstoff-Atome bilden ein Kohlenstoffgitter, in welches sich die kleinen Lithium-Ionen einlagern können. Im geladenen Zustand lagert sich ein Lithium-Ion durchschnittlich bei sechs Kohlenstoffatomen ein. Am Pluspol werden verschiedene Metalle genutzt, welche ebenfalls die Fähigkeit besitzen Lithium-Ionen einzulagern. Beispiele dafür sind: Cobalt, Nickel oder Mangan. Die Zusammensetzung der Cobalt-Verbindung wird mit LiCoO2 beschrieben. Es liegt also in der Oxidationsstufe +III vor.
Ladeprozess
Beim Ladevorgang wandern Elektronen vom Ladegerät zum Minuspol. Um dies auszugleichen wandern dann auch Elektronen vom Pluspol zum Ladegerät. Vor dem Laden liegt das Lithium-Cobalt-Dioxid Molekül ungeladen mit folgenden Oxidationsstufen vor.
Li+ICo+IIIO2-II
Wenn jetzt ein Elektron abgegeben wird, wird das Cobalt eine Stufe höher oxidiert. Es liegt also wie folgt vor:
Li+ICo+IVO2-II
Wenn man jetzt die Oxidationszahlen zusammenrechnet wird deutlich dass es im Molekül eine psoitive Ladung zu viel gibt. Um dies auszugleichen löst sich ein Lithium-Ion und wandert durch das mikroporöse, für Lithium-Ionen durchlässige Diaphragma.
Co+IVO2-II+e-+Li+
Auf der anderen Seite nimmt dieses Lithium-Ion dann ein Elektron auf und lagert sich in die Kohlenstoffschicht ein.
Entladeprozess
Wenn nun ein Verbraucher angeschlossen wird kehrt sich der Elektronenfluss um. So werden auf Seite der Anode die Elektronen wieder abgegeben und auf Seiten der Kathode wieder aufgenommen. Dadurch wird das Lithium in der Kohlenstoffschicht wieder oxidiert und der Cobalt-Dioxid-Komplex wieder reduziert. So wird der Lithium-Cobalt-Dioxid-Komplex wieder vollständig hergestellt.
Li -> Li+ + e-
Co+IVO2-II+e- -> Co+IIIO2-II
Co+IIIO2-II+Li+ -> Li+ICo+IIIO2-II
Redoxgleichungen
Ox: LiCoO2 ⇌ CoO2 + Li+ + e-
Red: Graphit + e- + Li+ ⇌ LiGraphit
Redox: CoO2+Graphit- + (Li+) ⇌ CoO2- + Graphit + (Li+)