Abiturwissen Chemie Oberstufe/Organische Chemie/Ester: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung |
KKeine Bearbeitungszusammenfassung |
||
| (Eine dazwischenliegende Version desselben Benutzers wird nicht angezeigt) | |||
| Zeile 5: | Zeile 5: | ||
===Eigenschaften:=== | ===Eigenschaften:=== | ||
Der Schmelz- und Siedepunkt von Estern sinkt gemeinsam mit der Kohlenstoffanzahl, dementsprechend gilt: '''je geringer die Kohlenstoffanzahl, desto geringer liegt auch der Schmelzpunkt.''' | Der Schmelz- und Siedepunkt von Estern sinkt gemeinsam mit der Kohlenstoffanzahl, dementsprechend gilt: '''je geringer die Kohlenstoffanzahl, desto geringer liegt auch der Schmelzpunkt.''' | ||
{| class="wikitable" | |||
|+Wertetabelle Siedetemperatur | |||
!Ester | |||
!Siedetemperatur | |||
|- | |||
|Methansäuremethylester | |||
|31,5 °C | |||
|- | |||
|Ethansäureethylester | |||
|77,1 °C | |||
|- | |||
|Propansäureethylester | |||
|99,3 °C | |||
|- | |||
|Butansäureethylester | |||
|120 °C | |||
|} | |||
Die Ester sind aufgrund ihrer '''geringen Polarität schwer bis gar nicht löslich'''. Durch die starke Polarität von Wasser werden die unpolaren Bereiche des Estermoleküls verdrängt, was zu einer '''räumlichen Trennung zwischen Wasser und Ester''' führt. Dieses Phänomen wird von der '''Dichte''' des Esters verstärkt, welche geringer als die von Wasser ist. Die Estermoleküle sind durch die geringe Polarität '''leicht entzündlich'''. | Die Ester sind aufgrund ihrer '''geringen Polarität schwer bis gar nicht löslich'''. Durch die starke Polarität von Wasser werden die unpolaren Bereiche des Estermoleküls verdrängt, was zu einer '''räumlichen Trennung zwischen Wasser und Ester''' führt. Dieses Phänomen wird von der '''Dichte''' des Esters verstärkt, welche geringer als die von Wasser ist. Die Estermoleküle sind durch die geringe Polarität '''leicht entzündlich'''. | ||
| Zeile 23: | Zeile 39: | ||
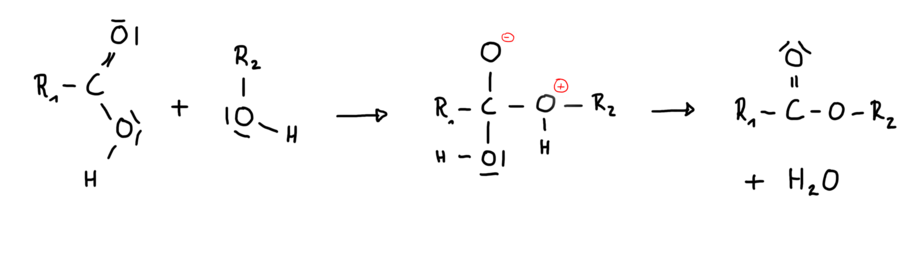
[[Datei:Reaktionsmechanismus ohne Katalysator.png|mini|911x911px]] | [[Datei:Reaktionsmechanismus ohne Katalysator.png|mini|911x911px]] | ||
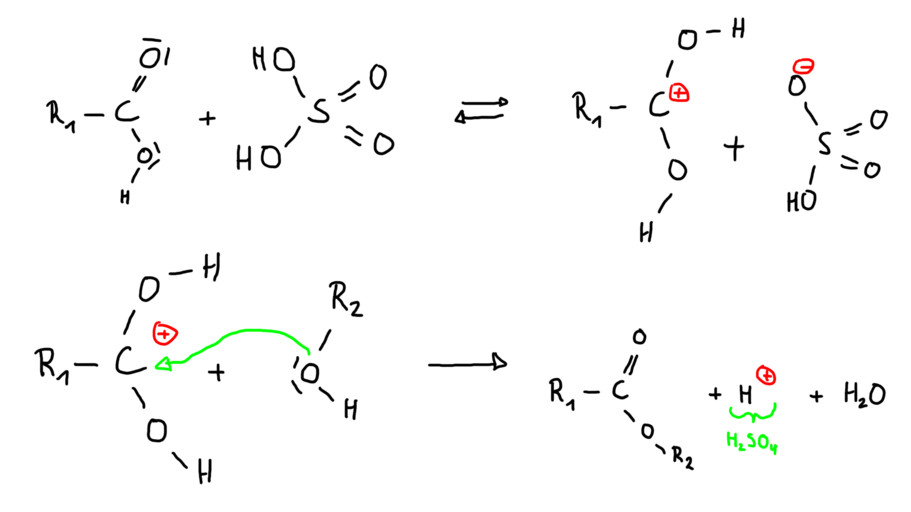
'''Reaktion mit Schwefelsäure als Katalysator:''' | '''Reaktion mit Schwefelsäure als Katalysator:''' | ||
[[Datei:Reaktionsmechanismus Ester mit Katalysator.png|mini|911x911px]] | [[Datei:Reaktionsmechanismus Ester mit Katalysator.png|mini|911x911px]]<br /> | ||
===Nomenklatur:=== | ===Nomenklatur:=== | ||
Es gibt zwei gültige Möglichkeiten, Ester zu benennen: | Es gibt zwei gültige Möglichkeiten, Ester zu benennen: | ||
| Zeile 35: | Zeile 50: | ||
===Vorkommen:=== | ===Vorkommen:=== | ||
*als Polyester in z. B. Kleidung oder Getränkeflaschen aus PET | *als Polyester in z. B. Kleidung oder Getränkeflaschen aus PET | ||
| Zeile 43: | Zeile 57: | ||
*die Acetylsalicylsäure als Wirkstoff in Kopfschmerztabletten | *die Acetylsalicylsäure als Wirkstoff in Kopfschmerztabletten | ||
*das Konservierungsmittel E218 in Lebensmitteln | *das Konservierungsmittel E218 in Lebensmitteln | ||
*Aspirin (Acetylsalicylsäure) | |||
Aktuelle Version vom 29. Oktober 2020, 23:08 Uhr
Allgemeines:
Die Ester sind eine Stoffgruppe in der Organischen Chemie. Sie entstehen während einer Kondensationsreaktion zwischen einem Alkohol und einer Carbonsäure. Der Begriff Ester stammt von einem historischem Vertreter (Essigsäureethylester) ab. Essigsäureethylester oder Ethylacetat wurde zur damaligen Zeit Essig-Äther genannt. Dieser Name für Ethylacetat hat den Begriff „Ester“ geprägt.
Eigenschaften:
Der Schmelz- und Siedepunkt von Estern sinkt gemeinsam mit der Kohlenstoffanzahl, dementsprechend gilt: je geringer die Kohlenstoffanzahl, desto geringer liegt auch der Schmelzpunkt.
| Ester | Siedetemperatur |
|---|---|
| Methansäuremethylester | 31,5 °C |
| Ethansäureethylester | 77,1 °C |
| Propansäureethylester | 99,3 °C |
| Butansäureethylester | 120 °C |
Die Ester sind aufgrund ihrer geringen Polarität schwer bis gar nicht löslich. Durch die starke Polarität von Wasser werden die unpolaren Bereiche des Estermoleküls verdrängt, was zu einer räumlichen Trennung zwischen Wasser und Ester führt. Dieses Phänomen wird von der Dichte des Esters verstärkt, welche geringer als die von Wasser ist. Die Estermoleküle sind durch die geringe Polarität leicht entzündlich.
Kurzkettige Ester (Alkohol C1 – C6 / Carbonsäure C1 – C6) werden Fruchtester genannt, da sie ein sehr intensives Fruchtaroma mitbringen. Sie sind Bestandteile der Aromen von z.B. Erdbeeren, Kiwis, Äpfeln und Bananen.
Langkettige Ester (Alkohol C16 – C32 / Carbonsäure C16 – C30) haben diese Eigenschaft nicht, sie bilden hingegen den Hauptbestandteil von natürlichen Wachsen z.B. Bienenwachs.
Reaktionsmechanismen:
Diese chemische Reaktion nennt man Veresterung.
Säure + Alkohol → Ester + Wasser
Reaktion ohne Katalysator:
Reaktion mit Schwefelsäure als Katalysator:
Nomenklatur:
Es gibt zwei gültige Möglichkeiten, Ester zu benennen:
Nach der ersten Methode - diese ist im Sprachgebrauch häufiger anzutreffen - wird der Name der Carbonsäure R1-COOH der Alkylgruppe des Alkohols R2 vorangestellt und mit der Endung -ester versehen, z.B. Octansäure-propyl-ester.
Die zweite Methode, ist die chemisch korrekte Bezeichnung eines Esters, die wie folgt gebildet wird: Die Bezeichnung der Alkylgruppe des Alkohols R2 wird der Bezeichnung des Alkans, von dem sich die Carbonsäure ableitet, vorangestellt und es wird anschließend die Endung „-oat“ angehängt, z.B. Propan-octan-oat.
Vorkommen:
- als Polyester in z. B. Kleidung oder Getränkeflaschen aus PET
- im Bienenwachs
- als Bestandteil von Fruchtaromen
- als Lösungsmittel im Klebstoff
- die Acetylsalicylsäure als Wirkstoff in Kopfschmerztabletten
- das Konservierungsmittel E218 in Lebensmitteln
- Aspirin (Acetylsalicylsäure)