Abiturwissen Chemie Oberstufe/Organische Chemie/ElektrophileSubstitution: Unterschied zwischen den Versionen
Markierung: Quelltext-Bearbeitung 2017 |
|||
| Zeile 39: | Zeile 39: | ||
<br /> | <br /> | ||
==='''Zweitsubstitution'''=== | ==='''Zweitsubstitution'''=== | ||
Ist bereits ein Substituent in den Benzolring eingefügt, verhält sich der Rest des Rings bei einer Zweitsubstitution anders als bei der Erstsubstitution. Unterschiedliche Substituenten führen dabei zu unterschiedlichem Verhalten. So beschleunigen einige Substituenten die Reaktion, da sie aktivierend wirken, andere hingegen verlangsamen sie. | Ist bereits ein Substituent in den Benzolring eingefügt, verhält sich der Rest des Rings bei einer Zweitsubstitution anders als bei der Erstsubstitution. Unterschiedliche Substituenten führen dabei zu unterschiedlichem Verhalten. So beschleunigen einige Substituenten die Reaktion, da sie aktivierend wirken, andere hingegen verlangsamen sie. | ||
Version vom 29. Oktober 2021, 15:23 Uhr
Elektrophile Substitution
Die elektrophile Substitution ist eine in der organischen Chemie typische Reaktion für Aromaten. Sie ist gekennzeichnet durch den Austausch eines Atoms oder einer Atomgruppe durch ein elektrophiles Teilchen, wobei der aromatische Bindungszustand erhalten bleibt. Man unterscheidet zwischen Erst- und Zweitsubstitution.
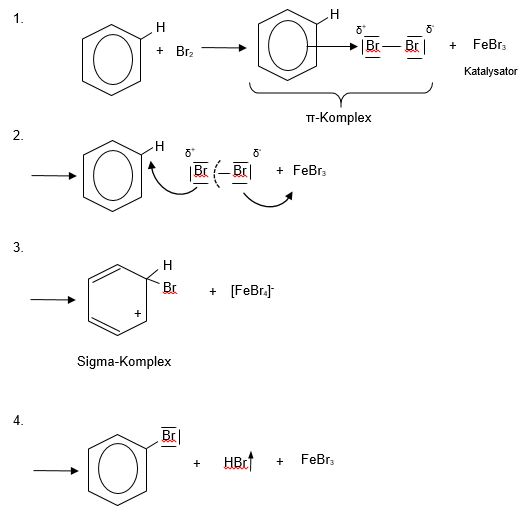
Erstsubstitution am Beispiel der Bromierung von Benzol
1. Der Benzolring verfügt auf Grund des aromatischen Systems über π-Elektronen und damit über eine hohe Elektronendichte. Dadurch kommt es zur Wechselwirkung mit dem Brommolekül. Aus dieser Wechselwirkung resultiert eine Elektronenverschiebung im Brom-Molekül, so dass das eine Brom-Atom eine positive das andere über eine negative Partialladung verfügt. Es kommt also zur Ausbildung eines π-Komplexes, der aber nicht weiterreagiert. Um die Reaktion in Gang zu setzen, muss zusätzlich ein Katalysator wie beispielsweise Eisen(III)-Bromid zugegeben werden.
2. Durch den Katalysator wird die Bindung im Brom-Molekül so stark polarisiert, dass es zur Heterolyse kommt, der Spaltung des Brom-Moleküls in ein elektrophiles (Br+) und nucleophiles Teilchen (Br-).
3. Das negativ geladene Brom-Ion wird an den Katalysator gebunden. Es entsteht ein FeBr4--Ion. Das elektrophile Teilchen wird durch Ausbildung einer Sigma-Bindung an das Benzol addiert. Dadurch bildet sich ein Sigma-Komplex mit einem positiv geladenen C-Atom (Carbenium-Ion). Das aromatische System ist zerstört.
4. Zur Wiederherstellung des aromatischen Systems muss nun ein Proton an der Stelle abgespalten werden, an der das Brom hinzugefügt wurde. Dies geschieht durch die Reaktion des Carbenium-Ions mit dem FeBr4--Ion. In Folge dessen bilden sich Brombenzol und Bromwasserstoff. Der Katalysator Eisen(III)-Bromid wird zurückgebildet und die elektrophile Substitution ist abgeschlossen.
Zweitsubstitution
Ist bereits ein Substituent in den Benzolring eingefügt, verhält sich der Rest des Rings bei einer Zweitsubstitution anders als bei der Erstsubstitution. Unterschiedliche Substituenten führen dabei zu unterschiedlichem Verhalten. So beschleunigen einige Substituenten die Reaktion, da sie aktivierend wirken, andere hingegen verlangsamen sie.
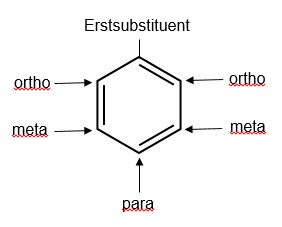
Der Erstsubstituent beeinflusst außerdem auf Grund von mesomeren und induktiven Effekten den Ort der Zweitsubstitution. Prinzipiell ist eine Zweitsubstitution an drei verschiedenen Positionen möglich, wobei die Stellung des Zweitsubstituenten relativ zum Erstsubstituenten angegeben wird. Man unterscheidet zwischen Ortho-, Meta- oder Para-Stellung.