Abiturwissen Chemie Oberstufe/Organische Chemie/Oxidationszahlen: Unterschied zwischen den Versionen
Aus ZUM Projektwiki
KKeine Bearbeitungszusammenfassung |
KKeine Bearbeitungszusammenfassung |
||
| Zeile 20: | Zeile 20: | ||
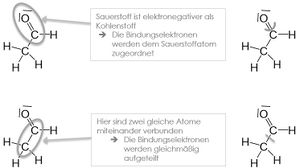
Zusammengefasst werden Bindungen zwischen einzelnen Atomen betrachtet. Das Bindungselektronenpaar wird dem elektronegativeren Bindungspartner zugeschrieben. | Zusammengefasst werden Bindungen zwischen einzelnen Atomen betrachtet. Das Bindungselektronenpaar wird dem elektronegativeren Bindungspartner zugeschrieben. | ||
== Beispiel in der Organischen Chemie == | ==Beispiel in der Organischen Chemie== | ||
<br /> | <br /> | ||
[[Datei:Ethanol.jpg|zentriert|Ethanal]] | [[Datei:Ethanol.jpg|zentriert|Ethanal]] | ||
Version vom 8. Januar 2021, 11:50 Uhr
Allgemein
Die Oxidationszahl wird hauptsächlich bei der Redoxgleichung gebraucht. Sie gibt an, wie viele Elementarladungen ein Atom innerhalb einer Verbindung formal aufgenommen beziehungsweise abgegeben hat. Dadurch lassen sich die Atome zur Reduktion oder Oxidation einteilen.
Kennt man die Oxidationszahl der einzelnen Atome, dann weiß man, welche Ladung die einzelnen Ionen haben, wenn das Molekül gespalten wird.
Regeln bei der Bestimmung
- Summe der Oxidationszahlen der Atome ergibt die Molekülladung
- Elementmoleküle haben die Oxidationszahl 0
- Bei einatomigen Ionen ist die Ladung gleich die Oxidationszahl z.B. Na+ → +I
- Wasserstoff:
- mit Nichtmetallen → +I
- mit Metallen → -I
- Fluor: immer -I
- Sauerstoff
- meistens -II
- Ausnahmen: Peroxide ( R-O-O-R ) z.B. H2O2 da -I oder in Verbindung mit Fluor O2F2 da +I
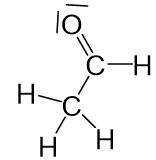
Zusammengefasst werden Bindungen zwischen einzelnen Atomen betrachtet. Das Bindungselektronenpaar wird dem elektronegativeren Bindungspartner zugeschrieben.
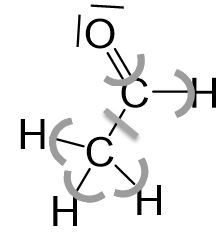
Beispiel in der Organischen Chemie
Keinem Wasserstoffatom ist ein Elektron zugeordnet. Daraus ergibt sich die Oxidationszahl +I.