Abiturwissen Chemie Oberstufe/Organische Chemie/Ester
Algemeines:
Die Ester sind eine Stoffgruppe in der Organischen Chemie, diese entstehen während einer Kondensationsreaktion zwischen einem Alkohol und einer Carbonsäure. Der Begriff Ester stammt von einem Historischem Vertreter (Essigsäureethylester) ab, Essigsäureethylester oder Ethylacetat wurde zur damaligen Zeit Essig-Äther genannt. Dieser Name für Ethylacetat hat den Begriff „Ester“ geprägt.
Reaktionsmechanismen:
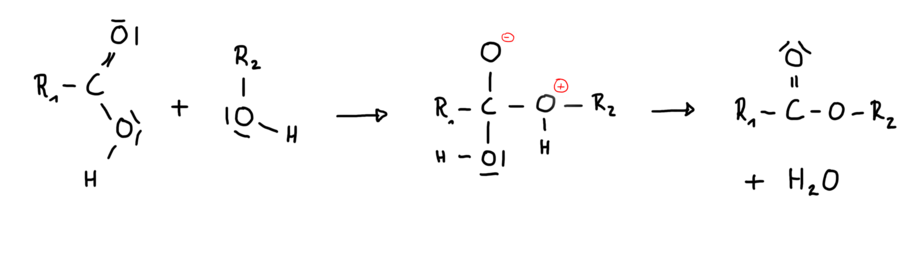
Reaktion ohne Katalysator:
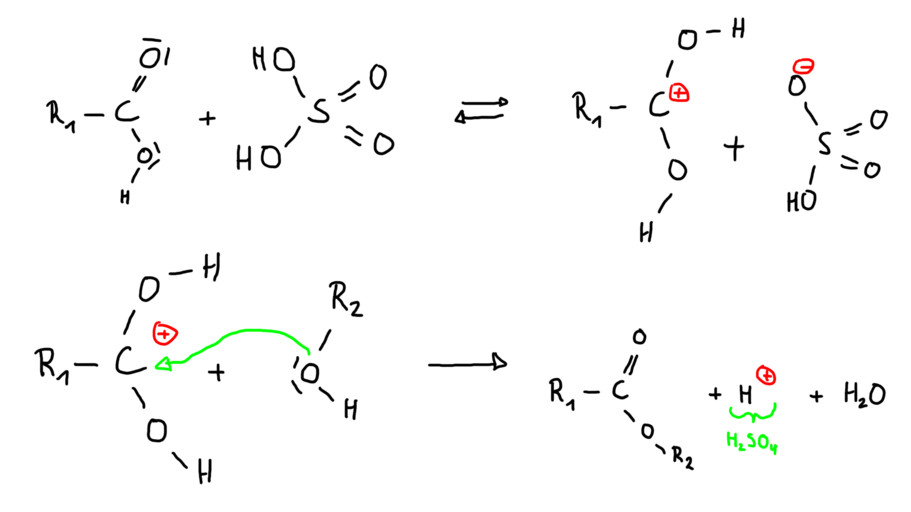
Reaktion mit Schwefelsäure als Katalysator:
Eigenschaften:
Der Schmelz und Siedepunkt von Estern sinkt gemeinsam mit der Kohlenstoffanzahl, dementsprechend gilt: je geringer die Kohlenstoffanzahl, desto geringer liegt auch der Schmelzpunkt.
Die Ester sind aufgrund ihrer geringen Polarität schwer bis gar nicht löslich, durch die starke Polarität von Wasser, werden die unpolaren Bereiche des Ester Moleküls regelrecht verdrängt was zu einer räumlichen Trennung zwischen Wasser und Ester führt. Dieses Phänomen wird von der Dichte der Ester verstärkt, diese ist geringer als die von Wasser. Die Ester Moleküle sind durch die geringe Polarität leicht entzündlich.
Kurzkettige Ester (Alkohol C1 – C6 / Carbonsäure C1 – C6) werden Fruchtester genannt, da sie ein Sehr intensives Frucht Aroma mitbringen. Sie sind Bestandteile der Aromen von z.B. Erdbeeren, Kiwis, Äpfeln und Bananen.
Langkettige Ester (Alkohol C16 – C32 / Carbonsäure C16 – C30) haben diese Eigenschaft nicht, sie bilden hingegen den Hauptbestandteil von Natürlichen Wachsen z.B. Bienenwachs.