Abiturwissen Chemie Oberstufe/Elektrochemie/Sekundärelemente/Elektrolyse von Schwefelsäure
Versuch: Volumen von Gasen
Der genaue Versuchsaufbau und die Durchführung der Elektrolyse sind hier zu finden. Wie aus diesem Versuch hervorgeht, bildet sich an der Kathode Wasserstoff und an der Anode Sauerstoff.
Die Gase, die an den jeweiligen Elektroden entstehen, werden pneumatisch aufgefangen, sodass das Volumen der entstehenden Gase gemessen werden kann.
Diese Messwerte können später mit den theoretisch errechneten Werten verglichen werden.
Theoretische Werte
Um das Volumen von idealen Gasen berechnen zu können, macht Eigenschaft nutze, dass diese immer das gleiche Volumen haben, unabhängig vom Stoff. Ein Großteil der Gase kann näherungsweise als ideale Gase behandelt werden, wenn die Temperatur konstant bei Raumtemperatur (ca. 20°C) liegt und Normaldruck herrscht.
Dementsprechend lässt sich die Stoffmenge aus dem molarem Volumen eines idealen Gases in L/mol und dem gemessenen Volumen des Stoffes ableiten.
| |
Nun gilt es eine Funktion zu finden mit der sich das Volumen des Gases berechnen lässt, welches sich an einer Elektrode bildet, in Abhängigkeit von Messwerten, wie der Stromstärke mit der die Elektrolyse läuft und der Zeit seitdem die Elektrolyse begonnen hat.
| |
|
Mit der Funktion lässt sich das Volumen, welches ein Gas, dass bei der Elektrolyse an einer der Elektroden entsteht, in proportionaler Abhängigkeit von der Stromstärke und der Zeit theoretisch berechnen.
Vergleich von Theorie und Praxis
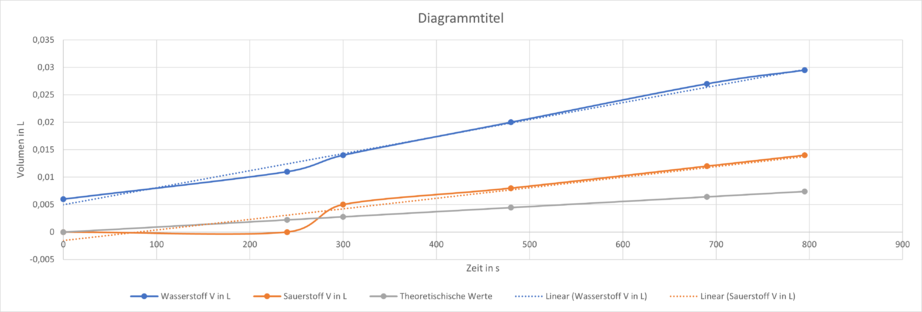
Bei der Elektrolyse wurde eine Stromstärke von 40 mA, also 0,04 A, gemessen. Das folgende Diagramm zeigt das gemessene Volumen der Gase Wasserstoff und Sauerstoff die bei der Elektrolyse an den Elektroden entstehen im Vergleich zu dem mit der oben genannten Formel theoretisch errechneten Wert.
Durch sogenannte „Lineare Regression“ der Messwerte wurde eine Näherungsgerade durch den Graphen der Messwerte gelegt (gepunktet), welche sich gut mit der Gerade für die errechneten Werte vergleichen lässt.
Es fällt auf, dass die Messung des Volumens des an der Anode entstandenen Sauerstoffes deutlich näher an den theoretischen Werten liegen, als die des Wasserstoffes. Die Steigung der Geraden ist die Änderungsrate, welche angibt, um wie viel Liter das Volumen des entstandenen Gases pro Sekunde zunimmt.
Die Differenz der Steigung der Näherungsgerade der Messwerte von dem entstandenem Sauerstoff und der Steigung der gerade von den theoretischen Werten liegt bei ca. , was eine verhältnismäßig geringe Abweichung ist. Die Abweichung beim Wasserstoff ist hingegen deutlich größer.